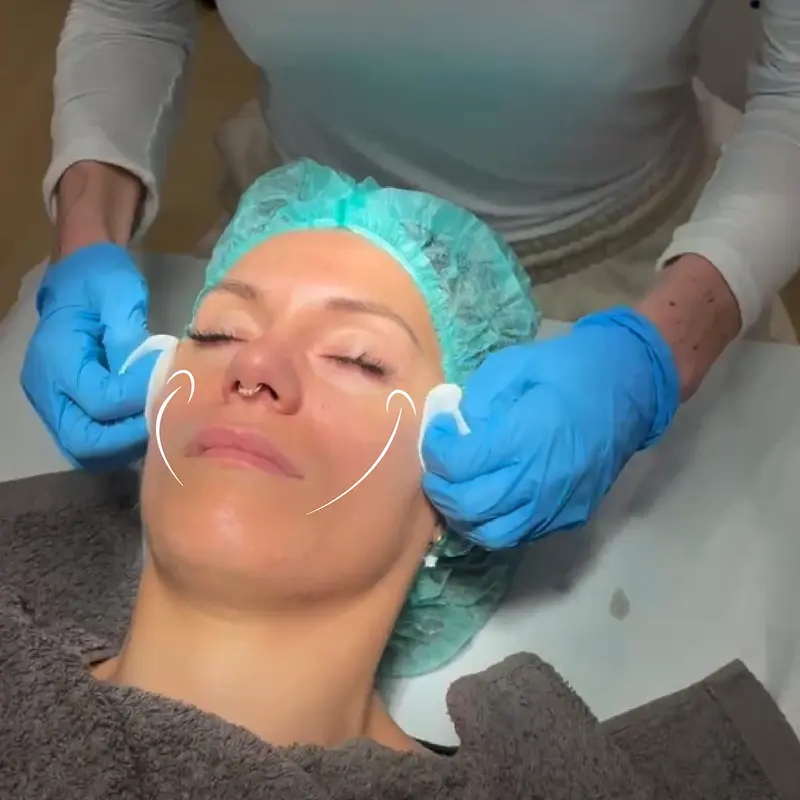
láser de co2 en vigo
En Centro Láser Vigo, tratamos diversas afecciones con nuestros láseres CO2, todas ellas relacionadas con las imperfecciones cutáneas. Conoce más a continuación.
Resurfacing y rejuvenecimiento facial: ¿Por qué elegir nuestro tratamiento?

Manchas y queratosis
Arrugas profundas

Cicatrices acné
1. Resultados duraderos
Nuestro enfoque con Láser CO2 ultrapulsado no solo mejora la apariencia de la piel, sino que también ofrece resultados duraderos, con beneficios visibles que perduran entre 5 y 10 años.
2. Eliminación de arrugas profundas
¿Deseas despedirte de esas arrugas profundas que te preocupan? Nuestro tratamiento está diseñado para hacer desaparecer incluso las arrugas más marcadas, proporcionando una apariencia más joven y fresca.
3. Disimulación de cicatrices de acné
Las cicatrices de acné pueden afectar la confianza en uno mismo. Con nuestro láser CO2, no solo reducimos, sino que también disimulamos estas cicatrices, consiguiendo una piel más uniforme.
4. Procedimiento menos invasivo
Nos enorgullece ofrecer un enfoque menos invasivo. Con una recuperación más rápida y menos molestias, puedes disfrutar de los beneficios del rejuvenecimiento facial sin largos periodos de inactividad.
5. Reducción y eliminación de manchas y queratosis
Después del «procedimiento menos invasivo», reducción y eliminación de manchas y queratosis. Además de abordar arrugas y cicatrices, nuestro procedimiento menos invasivo se centra en la reducción y eliminación de manchas y queratosis, mejorando la textura y tonacidad de tu piel.
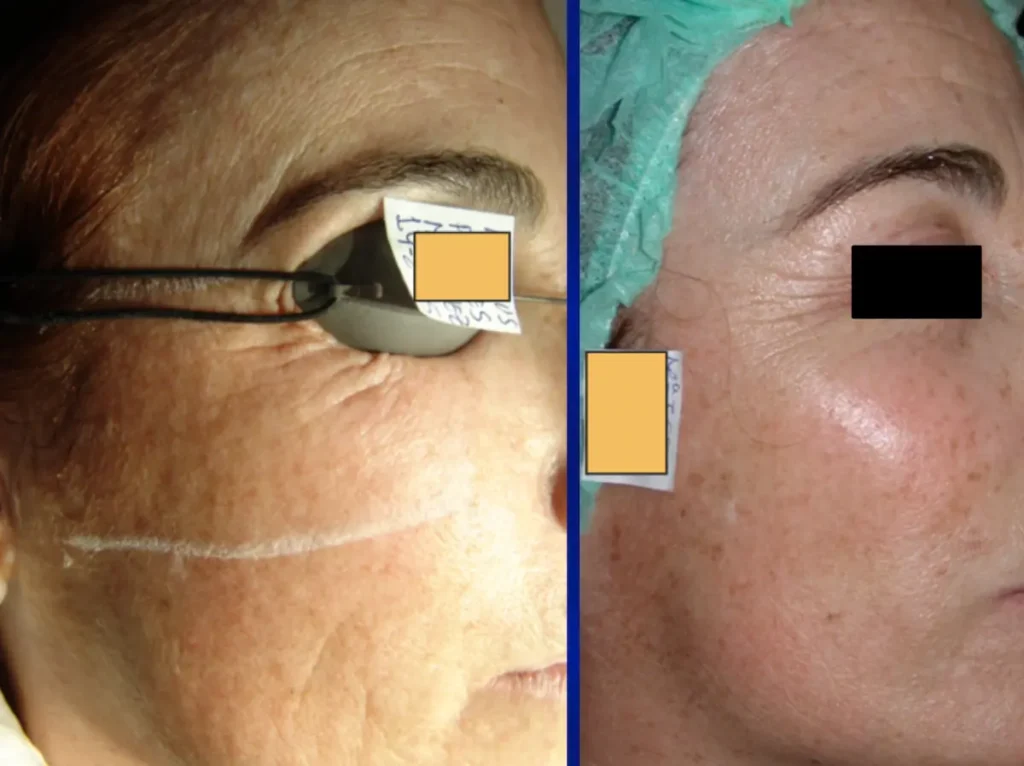
Tecnología avanzada: ¿Cómo funciona nuestro láser CO2?
Fototermólisis precisa
Nuestros láseres CO2 utilizan la fototermólisis para destruir selectivamente tejidos no deseados. La capacidad de vaporizar el agua en los tejidos a una temperatura específica garantiza un procedimiento preciso y seguro.
Mínimo daño térmico residual
La técnica ultrapulsada de nuestro láser CO2 minimiza el daño térmico residual, asegurando resultados óptimos con una recuperación más rápida y menos molestias.
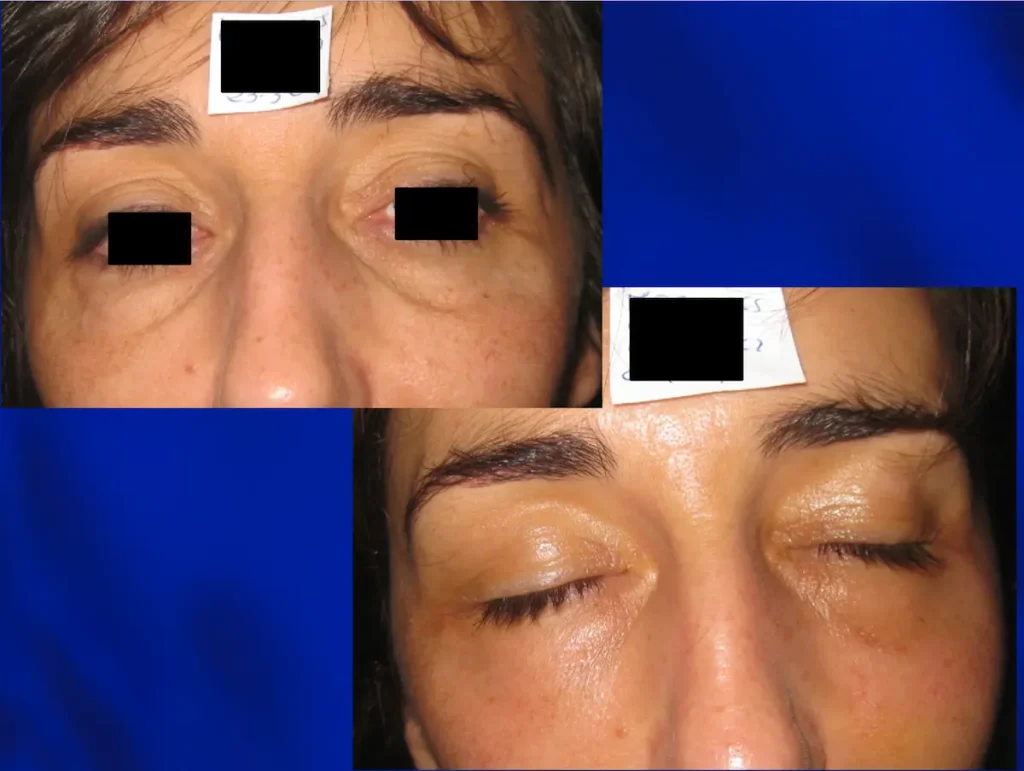
Casos de éxito: Transformando vidas a través de la piel
Hemos realizado más de 100 procedimientos con nuestro láser CO2, logrando casos de éxito que hablan por sí mismos. Desde la reducción de arrugas hasta la mejora de la textura cutánea, nuestros pacientes han experimentado transformaciones notables.
Tu bienestar es nuestra prioridad
En Centro Láser Vigo, creemos en la importancia de la atención personalizada. Cada paciente es único, y adaptamos nuestros tratamientos para satisfacer tus necesidades específicas.
Post tratamiento y cuidados específicos
Después del procedimiento, te proporcionaremos pautas detalladas para garantizar una recuperación sin complicaciones. Nuestro equipo estará disponible para responder a todas tus preguntas y brindarte el apoyo necesario durante todo el proceso.
Agenda tu consulta personalizada en Centro Láser Vigo y da el primer paso hacia una transformación notable. Tu piel merece lo mejor, y estamos aquí para proporcionártelo.
¿Tienes más preguntas?
Ponte en contacto y resólveremos tus dudas lo antes posible.
teléfono: 986 41 41 42
Whatsapp: 678 220 550
Mail:
centrolaservigo@centrolaservigo.com